জৈব যৌগের কার্যকরী মূলক বা পরিচায়ক শ্রেণি (Functional group of Organic Compound):
অসংখ্য জৈব যৌগকে, ওদের রাসায়নিক ধর্মের ওপর ভিত্তি করে কতকগুলি শ্রেণিতে ভাগ করা হয়েছে । দেখা যায় যে, এই রকম প্রতিটি শ্রেণিতে যৌগগুলির মধ্যে একটি বিশেষ মূলক বর্তমান থাকে । এই মুলকের উপস্থিতির জন্য ওই শ্রেণির সমস্ত যৌগের রাসায়নিক ধর্ম প্রায় একই রকম হয় । যেমন- OH মূলকবিশিষ্ট মিথাইল অ্যালকোহল (CH3OH), ইথাইল অ্যালকোহল (C2H2OH) প্রভৃতি একই রকম রাসায়নিক বিক্রিয়া করে ।
যেসব মূলক, জৈব যৌগের অণুতে উপস্থিত থেকে যৌগগুলির রাসায়নিক ধর্ম নির্ধারণ করে, সেসব সক্রিয় মূলককে কার্যকরী মূলক (Functional group) বলে ।
বিভিন্ন ধরণের কার্যকরী মূলক জৈব যৌগে উপস্থিত থেকে বিভিন্ন শ্রেণির যৌগ উৎপন্ন করে । কতকগুলি কার্যকরী মূলকের সংকেত এবং ওদের দ্বারা সৃষ্ট যৌগের শ্রেণির নাম দেওয়া হল ।
|
কার্যকরী মূলকের নাম |
কার্যকরী মূলকের সংকেত |
যৌগের শ্রেণির নাম |
উদাহরণ |
|
কার্বন-কার্বন দ্বি-বন্ধন |
অ্যালকিন | ইথিলিন, |
|
|
কার্বন-কার্বন ত্রি-বন্ধন |
—C ≡ C— | অ্যালকাইন | অ্যাসিটিলিন, (H - C ≡ C - H) |
| হাইড্রক্সিল | —OH | অ্যালকোহল, ফেনল |
C2H5OH (ইথাইল অ্যালকোহল), C6H5OH (ফেনল বা কার্বলিক অ্যাসিড ) |
| অ্যালডিহাইড | অ্যালডিহাইড |
HCHO (ফরম্যালডিহাইড), CH3CHO (অ্যাসিট্যালডিহাইড) |
|
| কার্বক্সিল | কার্বক্সিলিক অ্যাসিড |
HCOOH (ফরমিক অ্যাসিড), CH3COOH (অ্যাসিটিক অ্যাসিড) |
|
| কিটোনিক | > C = O | কিটোন |
CH3COCH3 (ডাই-মিথাইল কিটোন বা অ্যাসিটোন |
| থ্যালাক্সি | —O—R | ইথার | CH3OCH3 (ডাই-মিথাইল ইথার ) |
| সায়ানো | —C ≡ N | সায়ানাইড | C2H5CN (ইথাইল সায়ানাইড) |
| অ্যালক্সি | এস্টার | CH3COOC2H5 (ইথাইল অ্যাসিটেট) | |
| অ্যামিনো | 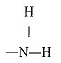 |
অ্যামিন | C2H5NH2 (ইথাইল অ্যামিন) |
| নাইট্রো | 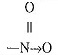 |
নাইট্রো | C6H5NO2 (নাইট্রোবেঞ্জিন) |
এখানে মনে রাখা দরকার > C = O শ্রেণিকে সাধারণভাবে কার্বনিল শ্রেণি বলা হয় । যদি অবশিষ্ট দুটি যোজ্যতার মধ্যে অন্তত একটি হাইড্রোজেন দ্বারা তৃপ্ত হয়, তবে শ্রেণিটিকে অ্যালডিহাইড শ্রেণি (-CHO) বলা হয় । আর যদি অবশিষ্ট দুটি যোজ্যতাই কার্বন দ্বারা তৃপ্ত হয়, তবে শ্রেণিটিকে কিটো শ্রেণি বলা হয় ।
*****
- 20454 views






