পরমাণুর ধারণা ও পরমাণুর গঠন
পরমাণুর ধারণা এবং ডালটনের পরমাণুবাদ (Concept of Atom and Dalton's Atomic Theory)
1808 খ্রিস্টাব্দে ইংরেজ বিজ্ঞানী স্যার জন ডালটন পদার্থের গঠন সম্পর্কে একটি সুনির্দিষ্ট বৈজ্ঞানিক তত্ত্ব প্রকাশ করেন । এই তত্ত্বটি ডালটনের পরমাণুবাদ (Dalton's Atomic Theory) নামে খ্যাত । পরমাণুবাদের মূল কথাগুলি হল :
(১) সব পদার্থই অসংখ্য অতি ক্ষুদ্র অবিভাজ্য নিরেট কণা দ্বারা গঠিত । পদার্থের এই ক্ষুদ্রতম কণার নাম পরমাণু (atom) ।
(২) পরমাণুগুলিকে রাসায়নিক প্রক্রিয়া দ্বারা ভাঙ্গা যায় না, সৃষ্টি করা যায় না বা ধ্বংস করা যায় না । পরমাণু অবিনশ্বর ও অবিভাজ্য ।
(৩) একই মৌলিক পদার্থের পরমাণুগুলি ওজনে ও ধর্মে অভিন্ন ।
(৪) বিভিন্ন মৌলিক পদার্থের পরমাণুগুলি ওজনে ও ধর্মে ভিন্ন ।
(৫) বিভিন্ন মৌলিক পদার্থের পরমাণুগুলি পূর্ণসংখ্যার সরল অনুপাতে পরস্পর যুক্ত হয়ে যৌগিক পদার্থ উৎপন্ন করে । যেমন — 1 : 1, 1 : 2, 2 : 3 ইত্যাদি ।
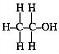
(৬) একই মৌলিক পদার্থের পরমাণুগুলি এক বা একের অধিক অনুপাতে যুক্ত হয়ে একাধিক যৌগিক পদার্থ উৎপন্ন করে । যেমন — NO, NO2, H2O, H2O2 ..... ইত্যাদি ।
পরমাণুর গঠন (Structure of Atom)
পদার্থের পরমাণু সাধারণত ইলেকট্রন, প্রোটন ও নিউট্রন এই তিনটি মূল কণা নিয়ে গঠিত । কেবলমাত্র সাধারণ হাইড্রোজেনের পরমাণুতে নিউট্রন নেই । প্রত্যেক পরমাণু দুটি অংশে বিভক্ত । যথা —
(i) ধনাত্মক তড়িৎযুক্ত পরমাণু-কেন্দ্রক বা পরমাণুর নিউক্লিয়াস (nucleus)
(ii) নিউক্লিয়াসের বাইরে ইলেকট্রন-মহল (extra nuclear electrons) ।
(i) ধনাত্মক তড়িৎযুক্ত পরমাণু-কেন্দ্রক বা পরমাণুর নিউক্লিয়াস : বিজ্ঞানী রাদারফোর্ড সোনার পাতে আলফা কণার (α -কণা) বিক্ষেপ পরীক্ষা করে প্রথম নিউক্লিয়াসের ধারণা করেন । পরীক্ষা লব্ধ ফল বিশ্লেষণ করে রাদারফোর্ড সিদ্ধান্ত করেন যে— পরমাণুর কেন্দ্রে একটি ক্ষুদ্র স্থানে পরমাণুর প্রায় সমগ্র ভর এবং ধনাত্মক আধান সঞ্চিত থাকে । পরমাণুর কেন্দ্রে ধনাত্মক আধানযুক্ত, ভারী ও অতি ক্ষুদ্র অংশটির নাম পরমাণু-কেন্দ্রক বা নিউক্লিয়াস ।
(ii) নিউক্লিয়াসের বাইরে ইলেকট্রন মহল : তড়িৎ নিরপেক্ষ পরমাণুতে প্রোটন ও ইলেকট্রন সমান সংখ্যায় থাকে । ইলেকট্রনগুলি নিউক্লিয়াসের বাইরে পরমাণুর বাকি অংশে বিভিন্ন কক্ষে বিন্যস্ত থাকে । ইলেকট্রনের এই বিন্যাসকে ইলেকট্রন-মহল বলে ।
*****
- 8721 views