সমযোজ্যতা (Covalent) :
অনেকক্ষেত্রে দুটি পরমাণু সংযোগের সময় প্রত্যেক পরমাণুর সবচেয়ে বাইরের কক্ষ থেকে একটি করে ইলেকট্রন এসে ইলেকট্রন জোড় সৃষ্টি করে । এই রকম এক বা একাধিক ইলেকট্রন জোড় উভয় পরমাণুর মধ্যে সাধারণভাবে থেকে যৌগ গঠন করে । এই ধরনের যৌগ তৈরি হওয়ার ক্ষমতাকে সমযোজ্যতা বলে । বিজ্ঞানী লিউইসের মতে এইভাবে অণু (মৌলিক বা যৌগিক) গঠনের সময় এক বা একাধিক ইলেকট্রন-জোড়কে দুটি পরমাণু সমানভাবে ব্যবহার করার ফলে উভয় পরমাণুই নিষ্ক্রিয় গ্যাসের ইলেকট্রন-বিন্যাস লাভ করে । এক্ষেত্রে এক পরমাণু থেকে অন্য পরমাণুতে ইলেকট্রন স্থানান্তরিত হয় না বলে পরমাণু দুটি নিস্তড়িৎ হয় ।
সমযোজ্যতার সংজ্ঞা (Covalent) :- নিকটতম নিস্ক্রিয় গ্যাসের পরমাণুর মতো স্থায়ী ইলেকট্রন-বিন্যাস লাভের জন্য দুটি অধাতব পরমাণু সমসংখ্যক ইলেকট্রন যুগ্মভাবে ব্যবহার করে এক বা একাধিক ইলেকট্রন-জোড় গঠনের মাধ্যমে রাসায়নিক বন্ধন সৃষ্টি করে । এরকম রাসায়নিক বন্ধন ঘটানোর ক্ষমতাকে সমযোজ্যতা বলে ।
ইলেকট্রন বিন্দু গঠন (Electron dot structure) :- পরমাণুর ইলেকট্রনকে বিন্দু (•) বা ক্রস (x) দিয়ে চিহ্নিত করে দুটি পরমাণুর মাঝে একজোড়া বিন্দু (:) বা ক্রস (xx) লিখে সমযোজী বন্ধনীসহ যৌগের যে গঠন প্রকাশ করা হয় তাকে ইলেকট্রন বিন্দু গঠন বা লুইস-বিন্দু গঠন (Lewis dot structure) বলা হয় । পরমাণুর সবচেয়ে বাইরের কক্ষের ইলেকট্রনকে এই জাতীয় গঠন সংকেতে দেখানো হয় ।
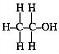
সমযোজী যৌগ :- নিকটতম নিষ্ক্রিয় গ্যাসের পরমাণুর মতো স্থায়ী ইলেকট্রন-বিন্যাস লাভের জন্য দুই বা ততোধিক অধাতব পরমাণু পরস্পরের মধ্যে এক বা একাধিক ইলেকট্রন জোড় সমভাবে ব্যবহার করে পরমাণুগুলির মধ্যে মিলন ঘটিয়ে যে যৌগ উৎপন্ন করে তাকে সমযোজী যৌগ বলে । যেমন H2, O2, N2, H2O, HCl, CH4 প্রভৃতি ।
*****
- 6454 views